新批准仿制药都能获得“通过一致性评价”标识吗?
通过新注册法规申报的仿制药该不该视同通过一致性评价?
本来笔者认为不是问题,但近日却有企业向药智网反映,其拥有某乳膏剂品种,想申报一致性评价,进而提高产品质量,但由于目前还没有关于皮肤外用化学仿制药一致性评价相关政策,无奈之下,采用“曲线救国”之法,用子公司的名义新申报一个仿制药,希望成为“视同通过一致性评价”品种。
但遗憾的是,当企业拿到药品批文去地方药监局申请/备案“视同一致性评价”标识时,却未获得通过。
药企管理者顿时蒙圈了,辛辛苦苦好几年,一看还在“解放前”。那么,新批准仿制药是否应该获得“通过一致性评价”标识?

“通过一致性评价”标识
图片来源:国家药监局
笔者对此进行梳理,从法规层面和情理层面探讨这类品种是否应当获得“通过一致性评价”标识。
对于新申报品种获得“通过一致性评价”标识的前提条件是什么?笔者认为,下面两个条件满足其一即可:
条件一:通过或视同通过一致性评价
根据国家药监局在2017年发布的《总局关于仿制药质量和疗效一致性评价工作有关事项的公告》(2017年第100号),“十六、‘通过一致性评价’标识是用于通过或视同通过一致性评价药品的药品标签、说明书的标识。通过及视同通过一致性评价的药品,自国家食品药品监督管理总局核发批准证明文件之日起,可在药品标签、说明书中使用‘通过一致性评价’标识。”
那么,本问题的焦点之一,就是新申报的外用制剂是不是“视同通过一致性评价”药品。
本公告同时提到:“对正在审评中的按照原化学药品注册分类受理的仿制药注册申请,申请人可评估是否满足现行一致性评价技术指导原则要求。经评估达到要求的,申请人可向国家食品药品监督管理总局药品审评中心提出按与原研药质量和疗效一致的标准审评的申请。国家食品药品监督管理总局审评通过的,视同通过一致性评价。”
业内人士都知道,如果出台一个《皮肤外用仿制药一致性评价技术指导原则》,与《皮肤外用仿制药研究技术指导原则》基本没有区别,也就没有必要再出台,按现指导原则等同于按一致性评价指导原则注册申报。
本公告虽然针对只是“正在审评中,按老注册法规申报”中的品种,那比这个更符合条件的新申报,按CDE最新公布的新注册法规《皮肤外用化学仿制药研究技术指导原则(试行)》(2021),笔者认为当然更应该视同通过一致性评价。
条件二:纳入《中国上市药品目录集》
2018年5月,CFDA发布《国家药品监督管理局关于阿托伐他汀钙片等12个品种规格通过仿制药质量和疗效一致性评价的公告(第四批)(2018年第24号)》,其中附件2明确指出:凡纳入与原研药可相互替代药品目录即《中国上市药品目录集》(现为《化学药品目录集》)的仿制药,可使用“通过一致性评价”标识。
此前,笔者有幸参与《中国上市药品目录集》建设。从下图可以看出,该使用指南明确提出收录药品的范围有四条,其中第二条便是“按化学药品新注册分类批准的仿制药”,且没有任何的限制内容或补充说明,也就是说,只要是“按化学药品新注册分类批准的仿制药”即可无条件纳入目录集。
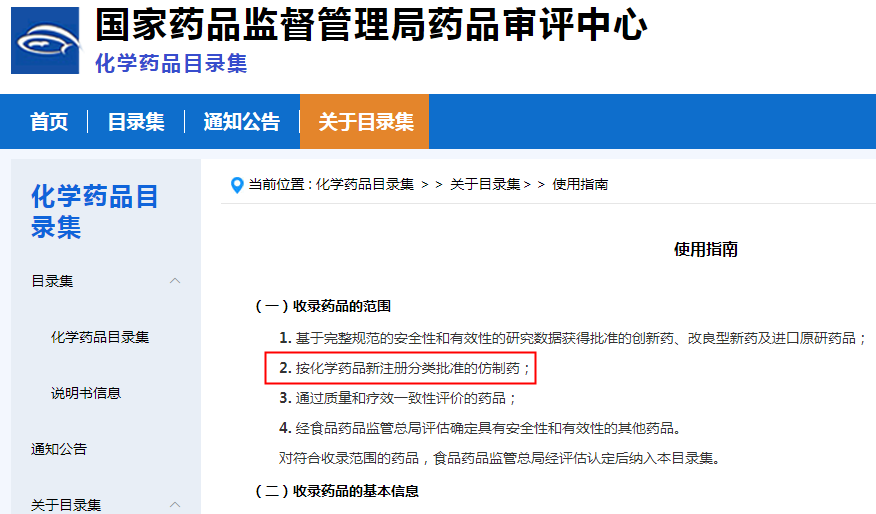
《中国上市药品目录集》使用指南(现为《化学药品目录集》)
图片来源:CDE
意味着,纳入该目录集即可使用“通过一致性评价”标识。
遗憾的是,笔者发现除口服固体制剂和注射剂外,其他剂型“按化学药品新注册分类批准的仿制药”在《中国上市药品目录集》基本没有收录,仅有为数不多的品种被收录。
以乳膏剂为例,笔者统计了2016年3月化学药品注册分类改革后按照新注册分类申报并获批的乳膏,共计7个药品批文,均未能在上市药品目录集收录。
有人可能认为:没有启动一致评性评价工作剂型的新批准仿制药不能纳入目录集,既然都没有开展“一致性评价”工作,哪来的“视同通过一致性评价”?
但笔者却认为,“按化学药品新注册分类批准的仿制药”就是按最新严格标准获批的仿制药,和过去的老品种做一致性评价,技术要求完全一样,唯一的不同仅为曾经有或没有药品批文而已。
而且这个和仿制药的剂型没有关系。此前,国家药监局在关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告(2016年第106号)还专门指出:评价的对像为“化学药品新注册分类实施前批准上市的仿制药,包括国产仿制药、进口仿制药和原研药品地产化品种,均须开展一致性评价。”企业率先在某个剂型开展相关的工作,应加以鼓励、给予出路,而不是加以限制。
综上所述笔者认为,解决问题的根本办法是,国家相关部门能够早日出台不同剂型的仿制药一致性评价政策,或补充申请通道;或明确提出,其他剂型也可以按仿制药指导原则开展一致性评价,才能促进其他各剂型的仿制药尽快提升质量,做到安全有效。
其次,《中国上市药品目录集》严格按其指南所讲范围,将所有“按化学药品新注册分类批准的仿制药”都纳入目录集,企业即可名正言顺的使用“通过一致性评价”标识。
第三,基于上述法规的本质和精神,地方药监局对于这类品种在申请“通过一致性评价”标识,并同意其备案申请,也算另外一种政策救济。
在相关政策的探索时期,企业本着法规的本质精神、积极探寻出路,呼吁相关部门加强沟通,让这些探索之路更加通畅。
声明:本文来源药智网,本文观点仅代表作者本人,不代表本网站立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间处理。



 beat365官方网站
All Rights Reserved
beat365官方网站
All Rights Reserved